Apéndice
La roya asiática de la soya: una nueva amenaza fitosanitaria.
Por Ing. Rigoberto González Gómez*Ago 22, 2008, 14:51

Antecedentes
La Dirección General de Sanidad Vegetal, mediante un monitoreo intensivo en cultivo de frijol soya, realizado por personal técnico de la misma y conjuntamente con el Dr. José Rafael Hernández del ARS Systematic Botany and Mycology Lab, USDA, en octubre de 2005 detectaron signos y síntomas sospechosos de la roya asiática en cultivos de soya en los municipios de Ébano y Taquín del Estado de San Luís Potosí, los cuales son colectados para realizar un estudio con técnicas tradicionales y moleculares. Estas muestras fueron positivas a la presencia de la roya asiática de la soya (Phakopsora pachyrhizi). Un mes después, la enfermedad fue detectada en los municipios de Altamira, González y Mante en el Estado de Tamaulipas. Dos años más tarde, en febrero de 2007 se detectó en el municipio de Papantla, Veracruz, la cual fue reportada y confirmada mediante pruebas moleculares en 1,800 hectáreas de jícama. El 23 de mayo del presente año se detectó roya asiática en 5 hectáreas de jícama en el municipio de Mapastepec, Chiapas.
Referencia de política en cuarentena vegetal
La roya asiática de la soya, a pesar de sus detecciones en los Estados de San Luís Potosí y Tamaulipas en cultivos de soya, así como en jícama, en el Estado de Veracruz, está considerada como una enfermedad reglamentada para la Dirección General de Sanidad Vegetal, por lo agresiva que es en estos cultivos, sin embargo, está confinada en los Estados mencionados. Así mismo, no se ha detectado, en otros estados de la República Mexicana con cultivos susceptibles, por ejemplo: Campeche, Guanajuato, Nayarit, Morelos, entre otros.
Situación de la enfermedad
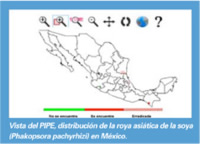 La roya asiática de la soya es una enfermedad de reciente ingreso a nuestro país que se ha presentado durante los dos últimos años en cultivos de soya en los estados de San Luis Potosí y Tamaulipas, así como en jícama en los estados de Veracruz y Chiapas, sin embargo, además de estos cultivos, también puede llegar a atacar a frijol (Phaseolus vulgaris), haba (Vicia fabae), y chícharo (Pisum sativum), entre otros cultivos de importancia económica para México y donde esta enfermedad no está presente aún. En los lugares donde ya se ha confirmado la presencia de este patógeno, personal técnico de los Organismos Auxiliares de Sanidad Vegetal, ha recibido capacitación para que, mediante el monitoreo y pruebas rápidas de detección oportuna, notifiquen a los Comités Estatales de su presencia e implementen las medidas de control de la enfermedad cuando el estado fenológico del cultivo lo amerite.
La roya asiática de la soya es una enfermedad de reciente ingreso a nuestro país que se ha presentado durante los dos últimos años en cultivos de soya en los estados de San Luis Potosí y Tamaulipas, así como en jícama en los estados de Veracruz y Chiapas, sin embargo, además de estos cultivos, también puede llegar a atacar a frijol (Phaseolus vulgaris), haba (Vicia fabae), y chícharo (Pisum sativum), entre otros cultivos de importancia económica para México y donde esta enfermedad no está presente aún. En los lugares donde ya se ha confirmado la presencia de este patógeno, personal técnico de los Organismos Auxiliares de Sanidad Vegetal, ha recibido capacitación para que, mediante el monitoreo y pruebas rápidas de detección oportuna, notifiquen a los Comités Estatales de su presencia e implementen las medidas de control de la enfermedad cuando el estado fenológico del cultivo lo amerite.
Epidemiología
El hongo causante de la roya asiática de la soya (Phakopsora pachyrhizi) es un parásito obligado (requiere tejido vivo para sobrevivir). Las pústulas formadas en las hojas producen esporas llamadas uredosporas, las cuales pueden ser diseminadas por el viento a grandes distancias. La dispersión aérea, principal vía de diseminación, de la roya de la soya, depende de la habilidad de las uredosporas para sobrevivir bajo condiciones ambientales encontradas durante su transporte. En un ensayo de un modelo de transporte aerobiológico realizado por el Departamento de Agricultura de Estados Unidos, se sugiere que las primeras uredosporas de la roya de la soya que invadieron a ese país, probablemente arribaron durante septiembre de 2004, asociadas al huracán Iván, (Isard et al., 2005). Para este evento, el patógeno tendría que haber sobrevivido a condiciones cambiantes de temperaturas, humedad relativa y radiación solar por un periodo de 9 a 12 días. Se ha reportado que las esporas de hongos son particularmente sensitivas a la luz UV y longitudes de onda de radiación solar, especialmente entre 0.25 y 0.27 μm (Rotem et al., 1985), sin embargo, estas longitudes de onda están prácticamente ausentes de la radiación solar recibida en la superficie de la tierra.
Hay otros reportes sobre la sobrevivencia de las uredosporas de este patógeno, tales como cuando las uredosporas son almacenadas en bolsas de plástico, éstas permanecieron viables hasta por 68 días. Otro, es que adicionando o removiendo la humedad de hojas infectadas, se redujo la viabilidad de las esporas (Misman y Purwati, 1985). También se menciona que hay sobrevivencia de las esporas hasta por 55 días cuando son guardadas en seco de 15 a 20° C, pero el congelamiento o cercano a temperaturas de congelamiento, reduce la viabilidad (Patil et al., 1997).
Además del amplio rango de hospedantes, el patógeno también tiene un complejo patrón de virulencia. Se han identificado tres razas entre 50 cultivos urediales usando un set de 5 cultivares/líneas diferenciales, lo cual hace más difícil el manejo de la enfermedad, enfocándose en el control químico en países donde no se cuenta con variedades tolerantes o resistentes.
Bajo condiciones ambientales ideales (18 a 25° C), las esporas germinan entre 1 a 4 horas después de la deposición en la hoja. La roya de la soya difiere de la mayoría de las otras royas en que tiene una penetración directa por las células epidermales y no por las aberturas de los estomas, como lo hacen las otras (Miles et al., 2003 y Hartman et al., 1999). Esta penetración directa a la superficie de la hoja ocurre dentro de 6 horas a temperaturas de 20 a 25° C. De 5 a 8 días después de la infección, la uredinia puede desarrollarse sobre la planta y puede continuar su desarrollo por 4 semanas, después de la infección inicial.
El desarrollo de uredinias secundarias puede ocurrir por 8 semanas más, al margen de la infección inicial. La producción de las uredosporas puede ocurrir a los 9 días después de la infección. Durante la temporada del cultivo, el ciclo de producción de esporas puede ocurrir numerosas veces y las esporas son fácilmente diseminadas por el viento. La roya de la soya alcanza su máximo potencial de desarrollo entre los 15 y 28° C y con un alto nivel de humedad relativa en un periodo de 6 a 12 horas (Agronomy Channel, 2005; USDA-APHIS, 2004), los periodos de rocío o humedad relativa menores a 6 horas no generan infección. Este patógeno no es transmitido por semilla.
En San Luís Potosí, lugar donde se hizo la primera detección de la roya asiática en la semana del 24 al 28 de octubre de 2005, las condiciones ambientales fueron de temperaturas promedio de 22.9, 21.1 y 17.7° C, para los meses de septiembre, octubre y noviembre, respectivamente, y los datos de precipitación en esos mismos meses fueron de 115.7, 163.1 y 10.5 mm., respectivamente; estas fueron las condiciones para que se diera la infección en los municipios de Ébano y Tamuín de ese Estado, ya que las temperaturas óptimas para la roya asiática son de los 18 a 25° C.
Semanas después, se detectó su presencia en Altamira y Mante, Tamaulipas, donde las temperaturas en el mes de octubre, noviembre y diciembre, fueron de 25.4, 21.7 y 19.2° C, respectivamente, así como la precipitación en octubre fue de 118.2 mm., reduciéndose para noviembre y diciembre a 13.9 y 20.3 mm., respectivamente.
Se reporta que es difícil estimar el número exacto de esporas liberadas en el viento, sin embargo, se ha indicado que podría haber 1012 esporas/ha/día (1 billón de esporas/día), cuando se tiene a la epifitia en su máxima expresión.
Algunos de los datos más precisos de experimentos de campo, han sido derivados de estudios hechos en Taiwán por el AVRDC. Los estudios de campo indicaron que bajas y altas temperaturas, debajo de 15 y arriba de 28° C, redujeron el número de lesiones y previnieron el desarrollo de las lesiones en el campo.
P. pachyrhizi es un hongo parásito obligado que produce tanto uredosporas como teliosporas, aunque la germinación de las teliosporas solo han sido estudiadas en el laboratorio (Saksirirat and Hoppe, 1991), sin embargo, poco se sabe del papel de la fase telial y posiblemente la aecial en el ciclo de vida. A la fecha, solamente las uredosporas se sabe que son funcionales y su sobrevivencia a través del año depende de la presencia de cultivos de soya u otro cultivo susceptible, de no ser el caso, entonces, solamente sobrevivirán sobre hospedantes alternantes. Para el caso de la región soyera de San Luís Potosí y Tamaulipas, se da el caso que en cultivos de invierno, hay renacencia de soya en cultivos de sorgo y maíz, por lo que se da nuevamente la infección en estas plantas de renacencia, y el inóculo se mantiene en periodos donde ya no es tiempo para el cultivo de soya.
A la fecha, la roya asiática de la soya en cultivos de soya, se ha reportado en los municipios de Ébano y Tamuín, San Luís Potosí (alrededor de 7,082 ha, SIAP, 2006), así como en la región de Aldama, Mante, González y Altamira, Tamaulipas (alrededor de 50,720 ha, SIAP, 2006) y Veracruz en el municipio de Pánuco; en el cultivo de jícama se ha reportado en el Estado de Veracruz en los municipios de Tampico Alto y Papantla (alrededor de 1, 800 ha. SIAP. 2006), y en el Estado de Chiapas en el municipio de Mapastepec.
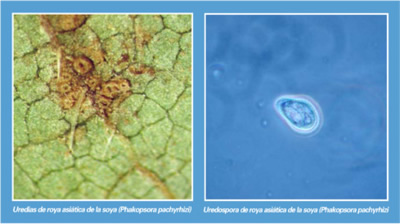
Rango de hospedantes
La roya asiática de la soya, es capaz de infectar a 31 especies de leguminosas, donde las principales hospedantes son: Glycine max (soya), G. soja, Cajanus cajan, Phaseolus vulgaris (frijol), P. lunatus, Pachyrhizus erosus (jícama), Vicia faba (haba) y Pisum sativum (chíncharo), así como las malezas Pueraria lobata, Vigna unguiculata y Lupinus spp. De acuerdo a esta información en México, los estados del país con cultivos susceptibles a la roya asiática son:
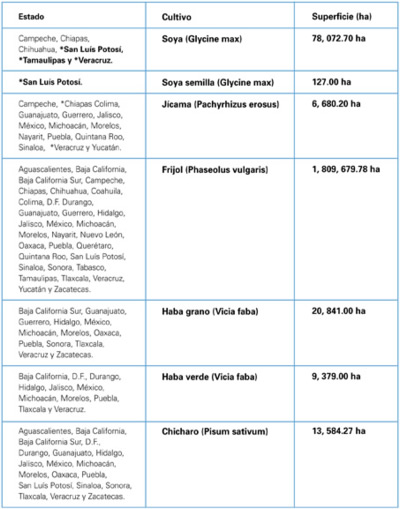
*Municipios del estado donde se han detectado y corroborado la presencia de la roya asiática (p.pachyrhizi)
Fuente: DGSV - 2008 Y SIAP - 2006
Rutas potenciales y dispersión
Según Miles et al., 2003, una de las posibles vías mediante las cuales la enfermedad puede transportarse, aparte de su diseminación por el viento y depositarse en cultivos de soya, es mediante puentes de áreas verdes de cultivos alternantes, hay que recordar que P. pachyrhizi, infecta a mas de 31 especies de leguminosas. En México, debido a la presencia de este patógeno, se llevó a cabo una reunión en el año 2007 en el Estado de Tamaulipas, donde asistieron autoridades de la Secretaría de Desarrollo Rural de los Estados de Veracruz, San Luís Potosí y Tamaulipas, principales estados productores de soya y acordaron que las siembras de Primavera-Verano, solo se realizarían en los meses de junio y julio, así como la identificación y destrucción de plantas hospedantes alternas, destrucción de nacencia de plantas de soya después de la trilla del ciclo. En el Estado de Tamaulipas se implementarían como medidas preventivas, el evitar las siembras del ciclo Otoño-Invierno, con el propósito de evitar ese puente verde de la roya asiática que le permita sobrevivir para el siguiente ciclo Primavera-Verano. En Veracruz, la jícama se sembró a mediados de julio hasta mediados de septiembre, lo cual, bajo condiciones ideales, propicia la infección de la roya asiática, por lo que el patógeno, además de infectar a este cultivo, puede perpetuarse en hospedantes alternos silvestres, ya que las condiciones climáticas del estado, pueden ser muy propicias para el desarrollo de la enfermedad y continuar a otras zonas del mismo estado o, por medio de fenómenos meteorológicos, dispersarse a otros estados e infectar a cultivos u hospedantes silvestres, tales como el resto del estado de Veracruz y Chiapas, donde se reportan varios hospedantes alternantes. Se señala más adelante, que pueden ser fuente de inóculo y diseminación para la soya de Chiapas y Campeche.
El hongo no se trasmite por semilla, pero si puede transportarse mediante material vegetal siempre y cuando se mantenga verde, ya que es un parásito obligado, esta situación puede ser propicia para el caso de jícama, la cual es muy probable su movimiento con follaje, cuando ésta es comercializada.
Puede darse el caso que en zonas donde ya se detectó y corroboró la presencia de la roya asiática, el inóculo existente no sea suficiente para iniciar la infección, o las condiciones ambientales no sean las ideales, pero puede coincidir el movimiento de esporas con cultivo susceptible presente y condiciones ideales para que se dé la infección, tal fue el caso de la jícama y soya en el Estado de Veracruz, donde estudios de pronóstico del movimiento de esporas, señalaban que había traslado de éstas hacia la región de Pánuco, Ver., y un mes más tarde (noviembre de 2007), fue detectada la enfermedad en ambos cultivos.
Implicaciones comerciales e impacto ambiental
y económico
En el 2005, la presencia de la roya asiática en las dos zonas mas importantes en producción de soya, Tamaulipas y San Luís Potosí, no fue de gran impacto debido a que la presencia de la enfermedad se presentó cuando el cultivo estaba en la etapa de llenado de grano, por lo que no fué factor preponderante que afectara la producción de esta leguminosa. Para el año siguiente, 2006, se pronosticaba un fuerte impacto en la producción de soya en los estados mencionados, ya que se tenía una fuente de inóculo muy importante, sin embargo, las condiciones ambientales no fueron las ideales para el patógeno y la incidencia de la enfermedad no fue impactante en la merma a la producción, sino por el contrario, al hacerse aplicaciones de plaguicidas para otras enfermedades foliares, propició una buena producción en el cultivo. En 2007, fue una situación similar en el cultivo de soya, tanto para San Luís Potosí, Tamaulipas y Veracruz, sin embargo, en este último estado, se tuvo la primera detección de roya asiática en cultivo de jícama, ya que tuvo un efecto devastador en las 1,800 hectáreas cultivadas en ese Estado. Recientemente, en mayo del presente año se detectó en 5 hectáreas de jícama en Mapastepec, Chiapas. Así mismo, este patógeno, a la fecha solo puede ser controlado mediante aplicaciones de agroquímicos, y solo son costeables a lo más dos aplicaciones en el ciclo del cultivo. Por el momento, no se cuenta con variedades tolerantes o resistentes, lo cual sería lo más recomendable, ya que el uso indiscriminado de plaguicidas, además de generar resistencia en el patógeno, contribuirá a la contaminación ambiental. El frijol es un cultivo en el que este patógeno podría causar efectos muy graves por la superficie sembrada y por la importancia socioeconómica, ya que es un cultivo presente prácticamente en todo el país. A este aspecto, es interesante mencionar que en dos localidades de Florida, USA, se ha reportado como hospedante de la roya de la soya al cultivo de frijol (http://sbr.ipmpipe.org/cgi-bin/sbr/public.cgi, 2007).
A continuación, se muestra una tabla donde se señala para el caso de México, a los cultivos hospedantes de la roya asiática, así como otros que son susceptibles de ser atacados, la superficie sembrada, así como el valor de la producción que se vería amenazada en caso de ser atacadas:
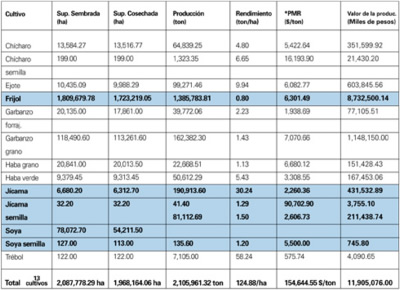
*Precio Medio Rural.
Fuente. SIAP. 2006
Acciones de coordinación y seguimiento
La SAGARPA a través de personal técnico de la Dirección General de Sanidad Vegetal, ha implementado cursos de capacitación a personal de los diferentes Organismos Auxiliares de Sanidad Vegetal (OASV), para que realice el monitoreo y detección de signos y síntomas de la roya asiática utilice técnicas de diagnóstico rápido y oportuno (tiras inmonostrip) y a través del Comité Estatal; se recomiende la aplicación de plaguicidas para el control de la enfermedad, siempre y cuando el estado fenológico del cultivo lo amerite, esto es antes del llenado de grano. Este personal de los OASV, también ha sido capacitado para llevar a cabo la georeferenciación de los puntos donde haya cultivos hospedantes a la roya asiática.
También se ha invitado a organizaciones gubernamentales de investigación, caso INIFAP, para que realice investigación en cuanto al estudio de germoplasma para generar líneas o variedades tolerantes o resistentes a la roya asiática, ya que es el método mas adecuado, económico y ambientalmente amigable.
Se ha dado la instrucción a personal de los Comités Estatales para que cuando se detecten síntomas y signos de la enfermedad, notifique y envié muestras al Centro Nacional de Referencia Fitosanitaria de la Dirección General de Sanidad Vegetal, para realizar la confirmación de la enfermedad mediante técnicas moleculares, ya que es el único medio para determinar con certeza la especie de la roya asiática.
La Dirección General de Sanidad Vegetal, ha implementado con apoyo de los OASV, empresas de agroquímicos e INIFAP, la instalación de parcelas centinelas en Tamaulipas, San Luís Potosí, Veracruz, Chiapas, Guanajuato y Campeche con el fin de monitorear a la roya asiática y hacer una detección oportuna de la misma, lo que permitirá ejercer acciones tendientes a proteger la producción de soya, jícama y frijol.
La Dirección General de Sanidad Vegetal en coordinación con los OASV, también lleva a cabo un monitoreo de hospedantes alternantes de la roya asiática en el estado de Veracruz y Chiapas, ya que según estudios de la Universidad Veracruzana, hay reportes de la distribución en ese Estado de especies de Fabaceas como: Cajanus cajan, Calopogonium caeruleum, Centrosema virginianum, Crotalaria sagittalis, Indigofera suffruticosa, Lablab purpureus, Macroptilium atropurpureum, Phaseolus lunatus, Pisum sativum, Pueraria phaseoloides, Vigna adenantha, Vigna luteola y Vigna unguiculata, las cuales en estudios realizados por Lynch et al., encontraron que son susceptibles a la roya asiática. También en el estado de Chiapas se reportan: Cajanus cajan, Crotalaria sagittalis, Lablab purpureus, Phaseolus lunatus, Pisum sativum, Vigna luteola y Vigna unguiculata (Breedlove, 1986).
Es de considerar la presencia de estos hospedantes alternantes en la zona agrícola de Chiapas, los cuales ponen en riesgo al cultivo de soya del estado, considerado como el segundo estado productor nacional de esta oleaginosa, además de ser una amenaza para la soya del estado de Campeche.
La Dirección General de Sanidad Vegetal implementará el uso de equipo cazaesporas de la roya asiática, en una primera parte donde ya se ha confirmado su presencia. Las esporas atrapadas serán objeto de estudio tradicional y molecular para diagnosticar si la roya asiática está presente mucho antes de que el cultivo esté en pie. Dichos resultados, servirán de cierta manera para pronosticar su presencia antes de que haya infección en el cultivo. También se podrá conocer cuanto inóculo por metro cúbico existe en el aire, y si es el necesario para que se produzca una infección. Dichos estudios se harán en coordinación con el Departamento de Ciencias Ambientales, en el área de Aerobiología de la Universidad Nacional Autónoma de México.
Conclusiones
1. En una cooperación binacional, la Dirección General de Sanidad Vegetal ha implementado el uso de una plataforma informática para la educación y extensión denominada PIPE que ha desarrollado el Departamento de Agricultura de Estados Unidos. Así mismo, en una perspectiva de seguimiento en tiempo real sobre la distribución de la enfermedad, la Dirección General de Sanidad Vegetal ha visualizado desarrollar el Sistema Coordinado de Operaciones para el manejo de Plagas reglamentadas y su Epidemiología (SCOPE), como un esquema de trabajo estandarizado para programas fitosanitarios estratégicos en el monitoreo de plagas reglamentadas. También, como parte del fortalecimiento del SCOPE se cuenta con la participación activa del sector productivo, representado a través de la Asociación Nacional de Industriales de Aceites y Mantecas Comestibles, A.C. (ANIAME).
2. Se busca alentar mediante la aprobación de proyectos de investigación para que instituciones como INIFAP, generen mediante su tecnología la liberación de líneas o variedades tolerantes o resistentes a la enfermedad. Se reporta resistencia específica a P. pachyrhizi, que está dada por cuatro genes simples dominantes Rpp1 (MCLean and Byth, 1980), Rpp2 (Bromfield et al., 1980), Rpp3 (Bromfield y Hartwig. 1980) y Rpp4 (Hartwig, 1986). Sin embargo, este tipo de resistencia no es durable, por lo que hay que dirigir la búsqueda a una resistencia parcial. En Brasil, Paraguay, China, Tailandia, Sudáfrica y Zimbabwe se han llevado a cabo evaluaciones para resistencia en planta adulta, así como investigaciones a la par para determinar el mejor camino para evaluar la resistencia parcial. Otras acciones será la búsqueda de otras medidas y/o prácticas de manejo de la enfermedad tales como manejo de las fechas de siembra, duración del ciclo del cultivo, porte del cultivo, eliminación del rastrojo del cultivo anterior, eliminación de hospedantes alternantes aledañas al terreno de cultivo, eliminación de soyas mostrencas en cultivos subsecuentes a la soya, etc., que permitirá elaborar un esquema de manejo integrado de la enfermedad.
3. Sumar esfuerzos para que el sistema producto oleaginosas, empresas de agroquímicos, INIFAP, realicen la Instalación de parcelas centinelas en zonas de cultivos susceptibles en estados de Morelos, Nayarit, Jalisco, Chihuahua, Colima, entre otros, lo cual servirá para monitorear la presencia o ausencia de la enfermedad.
Bibliografía citada:
1. Agronomy Channel. 2005. Asian soybean rust migration. www.midwestseed.com. Consultado el 08/febrero/2005.
2. Breedlove*, D. E. 1986. Listados florísticos de México. IV Flora de Chiapas.Instituto de Biología de la UNAM. * California Academy of Sciences. San Francisco, California 94118, USA
3. Bromfield, K. R., and Hartwig, E. E. 1980. Resistance to soybean rust [P. pachyrhizi] and mode of inheritance. Crop Sci. 20:254-255.
4. Hartwig, E. E.1986. Identification of a fourth major gene conferring resistance to soybean rust. Crop Sci. 26:1135-1136.
5. McLean, R. J., and Byth, D. E. 1980. Inheritance of resistance to rust (P. pachyrhizi) in soybeans. Aust. J. Agric. Res. 31:951-956.
6. Isard, S. A.., Gage, S. H., Comtois, P., and Russo, J. M. 2005. Principles of the atmospheric pathway for invasive species applied to soybean. Bioscience 55:851-862.
7. Lynch1, T. N1., Miles2, M. R.., Frederic3, R.D., Bonde3, M. R., Hartamn1,2, G. L.. Alternative hosts to Phakopsora pachyrhizi , the causal agent of soybean rust. 1Dept. of Crop Sciences, University of Illinois at Urbana-Champaign, Urbana IL 61801 2USDA-ARS, National Soybean Research Center, Urbana IL 61801 3USDA-ARS, Foreign Diseases-Weed Sciences Research Unit (FDWSRU), Ft. Detrick, MD 21702.
8. Misman, R. and E.S. Purwati. 1985. A study on host plant types of soybean rust fungi (Phakopsora pachyrhizi Syd.) on various types of legumes. Bull. Ilmaih Unsoed 11:68-82.
9. Patil, V.S., R.V. Wuike, C.S. Thakare, and B.B. Chirame. 1997. Viability of uredospores of Phakopsora pachyrhizi Syd. at different storage conditions. J. Maharashtra Agric. Univ. 22:26-261.
10. Plataforma de información para la Educación y Extensión (PIPE) http://sbr.ipmpipe.org/cgi-bin/sbr/public.cgi, 2007. Consultado el 22 de marzo de 2007.
11. Rotem, J., Wooding, B., and Aylor, D. E. 1985. The role of solar radiation, especially ultraviolet, in the mortality of fungal sores. Phytopathology 75:510-514.
12. SIAP. 2006. Anuario Estadí stico Agrícola.
13. Saksirirat, W., and Hoppe, H. H. 1991. Teliospore germination of soybean rust fungus (Phakopsora pachyrhizi Syd.). J. Phytopathol. 132:339-342.
14. USDA-APHIS. 2004. status of scientific evidence on risks associated with the introduction into the continental United States of Phakopsora pachyrhizi with imported soybean grain, seed and meal. United States Department of Agriculture. Animal and Plant Health Inspection Service. Plant Protection and Quarentine. USA. February 23, 2004.
*Ing. Rigoberto González Gómez, Coordinador Operativo; Dr. Javier Trujillo Arriaga, Director General de Sanidad Vegetal; Ing. Francisco Ramírez y Ramírez, Director del CNRF; M. C. Ricardo Pérez Zubiri, Subdirector de Diagnóstico Fitosanitario; M. C. Antonio Cárcamo Rodríguez, Coordinador del Laboratorio de Micología.
